Dalam perjalanan ke dunia mikroskopis atom, kita menemui konsep yang menarik dan penting: pembentukan konfigurasi elektron.
Melalui pembebasan konfigurasi elektron, kita membuka jendela ke dunia kecil di mana interaksi subatom terungkap.
Mari kita jelajahi bersama setiap langkah menuju pemahaman mendalam tentang cara atom mengorganisir elektronnya, membentuk keberagaman dan keunikan unsur-unsur di alam semesta kita.
Mengungkap Misteri Atom: Konfigurasi Elektron dan Tata Letak Elektron dalam Atom
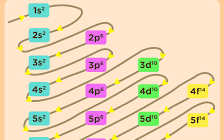
Konfigurasi elektron adalah tata letak dan distribusi ruang elektron di sekitar inti atom. Artikel ini akan memandu kita melalui konsep ini, membuka pintu ke dunia mikroskopis di mana partikel subatom
Atom terdiri dari inti yang terdiri dari proton dan neutron yang diapit oleh elektron. Inti atom membawa muatan positif, sementara elektron membawa muatan negatif.
Orbital adalah wilayah ruang di sekitar inti atom di mana elektron dapat ditemukan dengan kemungkinan tertentu.
Orbital ini dapat berbentuk seperti bola (s orbital) atau seperti dumbbell (p, d, dan f orbital). Setiap orbital dapat menampung sejumlah elektron tertentu.
Konfigurasi elektron digambarkan menggunakan bilangan kuantum, seperti n (bilangan kuantum utama), l (bilangan kuantum azimutal), m (bilangan kuantum magnetik), dan s (spin kuantum).
Prinsip eksklusi Pauli menyatakan bahwa dua elektron dalam suatu atom tidak dapat memiliki empat bilangan kuantum yang sama.
Elektron dalam atom mengisi tingkat energi yang berbeda dan dibagi menjadi sub-tingkat energi. Tingkat energi ini diidentifikasi oleh bilangan kuantum utama (n), sementara sub-tingkat energi diidentifikasi oleh bilangan kuantum azimutal (l).
Konfigurasi elektron dapat disajikan dalam bentuk diagram kotak atau diagram garis. Diagram kotak menunjukkan orbital
sebagai kotak yang diisi dengan panah yang menunjukkan spin elektron, sedangkan diagram garis menggunakan garis untuk mewakili orbital.
Aturan Hund menyatakan bahwa elektron akan memasuki orbital-orbital yang memiliki energi sama dengan jumlah terendah dan seiring waktu akan mengisi orbital yang lebih tinggi.
Prinsip Aufbau menyatakan bahwa elektron akan memasuki orbital-orbital dengan energi terendah terlebih dahulu.
Melalui pemahaman konfigurasi elektron, kita dapat memahami cara atom berinteraksi dan membentuk molekul.
Ini adalah kunci untuk memahami kimia dan memprediksi sifat materi di tingkat mikroskopis, memberikan landasan untuk pemahaman mendalam tentang dunia atom dan molekul.
Menelusuri Dasar Materi: Struktur Atom dan Molekul

Struktur atom dan molekul adalah dasar dari segala materi di alam semesta ini. Dalam artikel ini, kita akan menjelajahi komponen inti atom
distribusi elektron, dan bagaimana atom berkumpul membentuk molekul yang membentuk dasar dari segala zat yang kita kenal.
Atom adalah unit terkecil dari suatu unsur yang masih mempertahankan sifat kimianya. Terdiri dari inti atom yang mengandung proton dan neutron, dikelilingi oleh elektron yang bergerak dalam orbital di sekitar inti.
Inti atom, pusat padat di tengah atom, mengandung proton yang bermuatan positif dan neutron yang tidak bermuatan.
Setiap tingkat energi dibagi menjadi sub-tingkat energi yang menciptakan distribusi orbital di sekitar inti atom.
Bilangan kuantum, termasuk n (bilangan kuantum utama), l (bilangan kuantum azimutal), m (bilangan kuantum magnetik), dan s (spin kuantum), digunakan untuk menjelaskan letak dan orientasi orbital di sekitar inti.
Molekul terbentuk ketika dua atau lebih atom bergabung melalui ikatan kimia. Ikatan ini dapat berupa ikatan kovalen, di mana elektron dibagi, atau ikatan ionik, di mana terjadi transfer elektron antar atom.
Ikatan kovalen terjadi ketika atom berbagi satu atau lebih pasangan elektron. Ini membentuk molekul di mana atom saling terikat oleh ikatan yang kuat.
Ikatan ionik terbentuk melalui transfer elektron antara atom, menciptakan ion bermuatan positif dan negatif yang tertarik satu sama lain. Ini menghasilkan ikatan yang kuat antara atom.
Struktur atom dan molekul menentukan sifat fisik dan kimia materi. Sifat-sifat ini melibatkan interaksi antara atom dan molekul yang membentuk susunan kimia yang unik.
Dengan memahami struktur atom dan molekul, kita dapat menggali rahasia sifat materi di sekitar kita. Ini membuka pintu untuk eksplorasi lebih lanjut dalam dunia kimia dan fisika
membantu kita memahami bagaimana bahan-bahan berinteraksi, berubah, dan membentuk segala sesuatu yang ada di alam semesta ini.
Mengungkap Jalinan Elektron: Pembentukan Konfigurasi Elektron dalam Atom
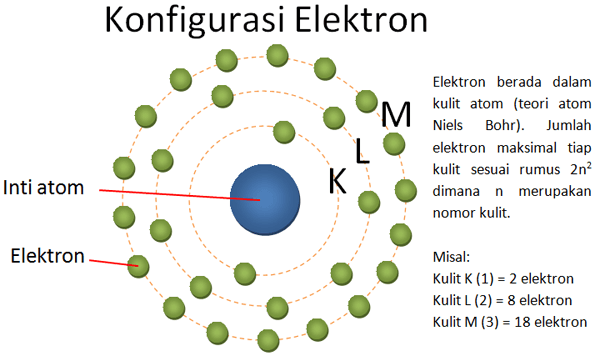
Konfigurasi elektron adalah tata letak elektron di sekitar inti atom, menciptakan pola yang teratur dan terstruktur.
Dalam artikel ini, kita akan membahas bagaimana konfigurasi elektron terbentuk, memahami prinsip-prinsip yang mendasari distribusi elektron di tingkat energi yang berbeda.
Tingkat energi dalam suatu atom menunjukkan energi rata-rata yang dimiliki oleh elektron-elektron yang mengisi tingkat tersebut.
Tingkat energi ini dibagi menjadi sub-tingkat energi, dan setiap tingkat memiliki sub-tingkat energi yang berbeda sesuai dengan bilangan kuantum azimutal (l).
Prinsip Aufbau menyatakan bahwa elektron akan memasuki orbital dengan energi terendah terlebih dahulu sebelum mengisi orbital yang lebih tinggi.
Ini menciptakan urutan pengisian tingkat energi dan sub-tingkat energi secara berurutan sesuai dengan nilai bilangan kuantum utama (n) dan bilangan kuantum azimutal (l).
Aturan Hund menjelaskan bahwa elektron akan memasuki setiap orbital yang sama dengan spin yang sama sebelum membentuk pasangan dengan elektron lain yang memiliki spin berlawanan.
Hal ini dilakukan untuk mencapai energi yang lebih rendah dan membuat distribusi elektron lebih stabil.
Orbit dalam suatu tingkat energi diidentifikasi oleh bilangan kuantum utama (n) dan bilangan kuantum azimutal (l).
Setiap orbit dapat menampung sejumlah orbital, dan setiap orbital dapat menampung dua elektron dengan spin yang berlawanan.
Pengisian orbital dimulai dengan orbital yang paling dekat dengan inti dan dilanjutkan ke orbital yang lebih tinggi.
Ini mengikuti prinsip Aufbau, Aturan Hund, dan Prinsip Eksklusi Pauli, menciptakan konfigurasi yang unik untuk setiap atom.
Beberapa unsur dapat mengalami perubahan konfigurasi elektron selama reaksi kimia atau membentuk ion dengan mendapatkan atau kehilangan elektron. Ini mempengaruhi sifat-sifat kimiawi unsur tersebut.
Dengan menyelami pembentukan konfigurasi elektron, kita dapat menggali lebih dalam tentang keunikan struktur atom
dan bagaimana distribusi elektron menciptakan keragaman dan pola yang membentuk dasar kimia dan fisika di alam semesta ini.
Baca Juga: https://ruangbimbel.co.id/penerapan-fungsi-invers/